Добавки в бетон — виды, характеристики, назначение
На современном этапе развития строительства перед производителем бетонных и железобетонных изделий стоит ряд достаточно трудоемких задач. Вместе с постоянным улучшением качества продукции, также необходимо подумать об обоснованности затрат энергетических и сырьевых ресурсов. Решением стало использование химических добавок в производстве бетона, которые позволяют не только добиться необходимого качества, но и позволяют значительно сократить затраты. В западных странах под конец двадцатого века объем бетона с добавками уже составлял 70 процентов. В нашей стране доля бетона с добавками на сегодняшний день составляет 50 процентов, и это значение продолжает неуклонно расти.
Зачем нужны добавки в бетон?
Что же представляют собой добавки для бетона? Это химические вещества, которые могут быть как органического, так и не органического происхождения. Встречаются в твердом и жидком состоянии, а также в форме паст различной степени консистенции. Всего в строительстве используется более трехсот различных наименований добавок. Столь обширное многообразие обусловлено различными модифицирующими эффектами. Поэтому для правильного выбора добавки необходимо четкое представление о цели, которую необходимо достичь.
Всего в строительстве используется более трехсот различных наименований добавок. Столь обширное многообразие обусловлено различными модифицирующими эффектами. Поэтому для правильного выбора добавки необходимо четкое представление о цели, которую необходимо достичь.
Классификация и виды добавок для бетона
Давайте более подробно разберем, какие из добавок используются для повышения качества и эффективности бетона:
- противоморозные добавки в бетон;
- пластификаторы;
- добавки для сохранения подвижности бетона;
- модифицирующие добавки;
- добавки для ускоренного набора прочности;
- добавки для самоуплотняющихся смесей.
Влияние добавок на свойства бетона
1. Противоморозные добавки в бетон. Неотъемлемым компонентом для приготовления раствора является вода. А что происходит с водой при минусовой температуре? Правильно, она превращается в лед, что представляет собой очень серьезную проблему при строительстве. Процесс гидратации (соединения цемента и воды) теряет динамику уже при температуре ниже пятнадцати градусов тепла, чего уже говорить о ситуации с отрицательным значением на термометре. Поддержание плюсовой температуры возможно прокладкой греющего провода или возведением вспомогательной опалубки. Данные меры помогают, но увеличивают время строительства и финансовые затраты. Основной принцип работы противоморозных добавок, это сохранять пластичность бетона при минусовой температуре, путем предотвращения замерзания жидкости, которая находится в смеси и благодаря этому, дает возможность смеси затвердеть и набрать прочность.
Процесс гидратации (соединения цемента и воды) теряет динамику уже при температуре ниже пятнадцати градусов тепла, чего уже говорить о ситуации с отрицательным значением на термометре. Поддержание плюсовой температуры возможно прокладкой греющего провода или возведением вспомогательной опалубки. Данные меры помогают, но увеличивают время строительства и финансовые затраты. Основной принцип работы противоморозных добавок, это сохранять пластичность бетона при минусовой температуре, путем предотвращения замерзания жидкости, которая находится в смеси и благодаря этому, дает возможность смеси затвердеть и набрать прочность.
2. Пластификаторы. Удобоукладываемость бетона является очень существенным фактором при строительстве, особенно если приходится иметь дело с тонкостенными конструкциями или опалубкой сложной геометрии. Также при укладке необходимо избежать образования пустот и полостей, которые крайне отрицательно сказываются на прочности и надежности бетонных конструкций. Пластификаторы позволяют добиться необходимого разжижения раствора при соблюдении требуемых пропорций компонентов (вода, песок и т.д.). Принцип действия основывается на повышении водоудерживающих характеристик раствора. В дополнении стоит отметить повышение прочности бетона с использованием пластификаторов (до 25%).
Пластификаторы позволяют добиться необходимого разжижения раствора при соблюдении требуемых пропорций компонентов (вода, песок и т.д.). Принцип действия основывается на повышении водоудерживающих характеристик раствора. В дополнении стоит отметить повышение прочности бетона с использованием пластификаторов (до 25%).
3. Добавки для сохранения подвижности бетонной смеси применяются в том случае, если необходима продолжительная транспортировка раствора. Их применение также находит место в теплое время года, так как при высокой температуре процесс застывания бетонной смеси проходит быстрее. Данные добавки увеличивают продолжительность процесса формирования структуры цементного камня посредством затруднения доступа молекул воды к частицам цемента, то есть замедления гидратации.
4. Модифицирующие добавки применяются для улучшения различных характеристик бетонной смеси. Часто встречается, что при возведении определенных сооружений, необходимо добиться от раствора конкретной плотности. Например, для строительства бассейна используется бетон с повышенной влагопроницаемостью, а для несущих конструкций зданий следует применять бетон с повышенным классом прочности. Воздухововлекающие, газообразующие и гидрофобизующие добавки помогут добиться необходимой пористости бетона в зависимости от поставленной задачи.
Например, для строительства бассейна используется бетон с повышенной влагопроницаемостью, а для несущих конструкций зданий следует применять бетон с повышенным классом прочности. Воздухововлекающие, газообразующие и гидрофобизующие добавки помогут добиться необходимой пористости бетона в зависимости от поставленной задачи.
5. Добавки для ускорения набора прочности. «Время – деньги» — фраза, в обоснованности которой, не возникает никаких сомнений, а темпы и сроки строительства зачастую зависят от скорости набора прочности бетона. Для ускорения этого процесса также используют добавки, например для многослойных конструкций, где ускоренное высыхание нижнего слоя позволяет заливать следующий слой бетонной смеси и при этом экономить время. Сокращению времени набора прочности способствует стимуляция процесса гидратации раствора. Разумеется, график строительства разрабатывается еще в проекте и должен неукоснительно соблюдаться. А как быть при возникновении форс-мажорных обстоятельств? В этом случае просто незаменимы добавки для ускорения набора прочности, которые помогут ликвидировать отставание от графика и избежать задержек строительства.
6. Добавки для самоуплотняющихся смесей нацелены на решение задач при создании густоармированных конструкций и возведении тонкостенных сооружений. Бетонная смесь с такой добавкой полностью заполняет форму и способна уплотняться лишь под действием собственного веса. Область их применения широка – начиная от создания монолитных полов повышенной прочности и заканчивая наращиванием прочности бетонных конструкций.
Как и много лет назад, бетон по-прежнему остается самым востребованным строительным материалом. Еще в Древнем Риме в раствор начали добавлять золу, которая помогала скрепить смесь. А соль, которая содержалась в морской воде, способствовала увеличению прочности и продлению «срока службы» возводимым сооружениям тех лет. На сегодняшний день невозможно себе представить создание высококачественно бетонного раствора с определенными характеристиками без каких либо добавок. К тому же добавки позволяют использовать бетонные смеси в любое время года, независимо от температуры окружающей среды. А придание бетонным смесям гидрофобных свойств позволяют использовать бетон для сооружения водных платин, водозаборных станций, бассейнов и других объектов. Благодаря добавкам в бетон можно значительно ускорять время строительных работ, оптимизировать расход цемента, и экономить денежные затраты. Также следует отметить, что изготовление сложных архитектурных форм не представляется возможным без применения пластифицирующих добавок.
А придание бетонным смесям гидрофобных свойств позволяют использовать бетон для сооружения водных платин, водозаборных станций, бассейнов и других объектов. Благодаря добавкам в бетон можно значительно ускорять время строительных работ, оптимизировать расход цемента, и экономить денежные затраты. Также следует отметить, что изготовление сложных архитектурных форм не представляется возможным без применения пластифицирующих добавок.
Инструкция по применению
Вся продукция ТД «Орион» укомплектована подробными инструкциями по применению добавок для бетона. Обязательно следует помнить о строгом соблюдении указанных пропорций, описанных в инструкциях. Незначительное отклонение от верных соотношений компонентов может испортить всю бетонную смесь, что, несомненно, повлечет за собой удорожание материалов и замедление хода строительства. Как гласит старая русская пословица: «Без меры и лапти не сплетешь».
В дополнении к вышесказанному, перед началом работ, мы настоятельно рекомендуем вам ознакомиться с рекомендациями производителей по технологии применения данных добавок.
Ассортимент добавок в бетон от компании «Орион»
В ассортименте компании Орион представлены следующие добавки для бетонных смесей:
- «Бетон-мороз» — добавка, позволяющая использовать бетонные смеси при температуре до -15 С.
- «Бетон-пласт» — пластификатор для повышения подвижности и удобоукладываемости бетонной смеси.
- «Бетон-гидро» — гидрофобизирующая добавка, которая делает бетон влагостойким, уменьшает впитываемость влаги.
Зачем добавляют клей ПВА в цементный раствор: tvin270584 — LiveJournal
Каждый хозяин заинтересован в том, чтобы приготовленный цементный раствор был как можно более качественным. На самом деле улучшить качества цемента не так сложно, как может показаться на первый взгляд. Существует один простой и доступный способ, к которому очень часто прибегают даже при строительстве крупных объектов. При замешивании растворов из песка и цемента, в них часто добавляют клей ПВА строительный: применение такой добавки позволяет улучшить эксплуатационные свойства и характеристики штукатурных или выравнивающих строительных смесей, даже бетона. В статье мастер сантехник расскажет, что дает добавление ПВА в цементный раствор, какой вид этого клея добавляют в цемент для крепости и в каком количестве.
Существует один простой и доступный способ, к которому очень часто прибегают даже при строительстве крупных объектов. При замешивании растворов из песка и цемента, в них часто добавляют клей ПВА строительный: применение такой добавки позволяет улучшить эксплуатационные свойства и характеристики штукатурных или выравнивающих строительных смесей, даже бетона. В статье мастер сантехник расскажет, что дает добавление ПВА в цементный раствор, какой вид этого клея добавляют в цемент для крепости и в каком количестве.
Состав клея ПВА
Состав клея ПВА несложен. Почти на 90–95 %клей состоит из ингредиента под названием поливинилацетат. Это химическое вещество представляет собой термопластичный полимер без цвета, запаха и вкуса. Поливинилацетат — продукт полимеризации винилацетата (винилового эфира уксусной кислоты). Основные свойства поливинилацетата: хладотекучесть, устойчивость к воздействию воздушной атмосферы, высокая степень адгезии к разным поверхностям, износостойкость и отличные оптические характеристики.
Клей ПВА — это водная эмульсия поливинилацетата. Кроме того, в состав клея ПВА входят пластификаторы и разные добавки. Назначение пластификаторов — обеспечить клеевой пленке морозоустойчивость и пластичность. Наиболее часто в клей добавляют дибутилфталат, диизобутилфталат, трикрезилфосфат, сложные эфиры. Процентное содержание пластификаторов в клее составляет около1–2 %.Применение специальных добавок придает ПВА необходимую густую консистенцию и повышает прочность сцепления при склеивании различных поверхностей.
Цементный раствор с клеем ПВА: свойства и преимущества
Учитывая, что водная клеевая эмульсия поливинилацетата – это разновидность полимеров, клей ПВА в цементном растворе выполняет функции пластификатора. Добавление ПВА в строительную цементно-песчаную смесь любого назначения позволяет:
- Улучшить пластичность и вязкость раствора;
- Увеличить прочность застывшей смеси на изгиб;
- Повысить прочность конструкции: добавка ПВА в цементно-песчаный раствор придает ему способность выдерживать нагрузку на разрыв не менее 1300 г/см2 при застывании;
- Усилить адгезионные свойства, что позволяет с помощью такой добавки получить отличный цементный раствор для штукатурки или плиточный клей;
- Упростить нанесение раствора.
К главным преимуществам использования клея ПВА в качестве пластифицирующей добавки к раствору для  Застывая, он не выделяет в воздух вредные для здоровья летучие соединения.
Застывая, он не выделяет в воздух вредные для здоровья летучие соединения.
Единственным ограничением к добавлению ПВА в цемент является невозможность использования такого раствора в помещениях с повышенной влажностью и наличием горячего пара (банях, бассейнах, ванных комнатах). Воздействие горячего влажного пара даже на связанный в бетоне поливинилацетат приводит к его гидролизу.
Какой клей ПВА добавляют в штукатурку и другие растворы с цементом
- Строительный клей ПВА, представляющий собой эмульсию на основе поливинилацетата с добавлением антисептиков и наполнителей, ускоряющих полимеризацию и отвердение – этот клеящий состав добавляют в штукатурный и кладочный раствор в пропорции 5-10% от его массы. А из смеси строительного ПВА и цемента М400 и М500 получается плиточный клей для укладки тяжелой керамогранитной плитки на вертикальную поверхность;
- Универсальный клей ПВА МБ – белая, с легким желтым оттенком, вязкая и однородная масса, используемая для приготовления штукатурки, грунтовки и любых видов бетона на водной основе.

- Дисперсию поливинилацетатную, отличающуюся прекрасной адгезией с любыми стройматериалами и хорошими связующими свойствами. Она выпускается двух видов: пластифицированная (не рекомендуется использовать при морозе) и морозоустойчивая непластифицированная. Дисперсия ПВА добавляется в любые виды строительных цементных растворов для улучшения их клеящих свойств.
Не подходит для добавления в строительную смесь из песка и цемента клей ПВА канцелярский и бытовой, из-за высокого содержания в них крахмала (до 80%), а также любые клеевые составы на основе поливинилацетата, предназначенные для склеивания дерева, поскольку в них содержится карбоксиметилцеллюлоза в большом количестве.
Как развести цементный раствор и сколько ПВА добавлять в него
В зависимости от назначения и области применения цементно-песчаного раствора, в него может добавляться от 5 до 20% клея ПВА.
Для устройства цементной стяжки пола достаточно будет 5-12% от объема смеси цемента, песка и мелкого щебня в соотношении 1:2:3.
Чтобы добавить в цементный раствор для штукатурки поливинилацетатный клей или дисперсию, необходимо, прежде всего, замешать сам раствор в следующем порядке:
- Смешать песок с цементом марки М400 в пропорции 3:1;
- Добавить воду, доведя смесь до консистенции густой сметаны;
- Клей ПВА в количестве 50-70 г на 10 л раствора разбавить водой и, влив полученное молочко в раствор, хорошо перемешать смесь.
В такой же последовательности добавляют ПВА в бетон, только в смесь песка и цемента перед добавлением воды вводится щебень, а добавка клея ПВА берется из расчета 200 г на 10 л раствора.
При замешивании раствора для укладки плитки нужно смешать цемент марки не ниже М400 с песком в соотношении 1:5, и, не добавляя воды, влить клей ПВА в количестве 20% от объема цементно-песчаной смеси.
Видео
В сюжете — Добавки к цементно-песчаному раствору
В сюжете — Клей ПВА для пластификации цементных растворов и бетонов
В продолжение темы посмотрите также наш обзор Замес бетона в бетономешалке — соотношение материалов
Источник
https://santekhnik-moskva.blogspot.com/2021/02/Zachem-dobavlyayut-kley-PVA-v-tsementnyy-rastvor.html
ПЛИТОНИТ АнтиМороз — противоморозная добавка для цементно-песчаных растворов
Ленинградская область
Санкт-Петербург
Бокситогорск
Васкелово
Волосово
Волхов
Всеволожск
Выборг
Выра
Вырица
Гатчина
Грузино
Дранишники
Заполье
Зеленогорск
Кингисепп
Кириши
Кировск
Колпино
Колтуши
Коммунар
Лодейное поле
Ломоносов
Лосево
Луга
Мичуринское
Мурино
Ново-Токсово
Отрадное
Павлово
Песочный
Пикалево
Приозерск
Псков
Романовка
Ропша
Рощино
Сестрорецк
Сиверский
Сланцы
Сосново
Сосновый Бор
Тихвин
Токсово
Тосно
Ульяновка
Черемыкино
Москва и Московская область
Алтуфьево
Видное
Владимир
Дмитров
Дубино
Дубна
Егорьевск
Зеленоград
Иваново
Истра
Климовск
Клин
Коломна
Кострома
Красногорск
Кубинка
Лосино-Петровский
Люберцы
Можайск
Мытищи
Ногинск
Одинцово
Орехово-Зуево
п. Соболиха
Соболиха
Павловский Посад
пгт. Белоозерский
Подольск
Пушкино
Раменское
Сергиев Посад
Серпухов
Сокольники
Старая Купавна
Тарасовка
Химки
Хотьково
Шолохово
Шуя
Щелково
Электросталь
Юдино
Ям
Ярославль
Алтайский край
Барнаул
Амурская область
Благовещенск
Архангельская область
Архангельск
Новодвинск
Северодвинск
Брянская область
Брянск
Волгоградская область
Волгоград
Волжский
Вологодская область
Белозерск
Великий Устюг
Вологда
Воронеж
п. Кадуй
п. Шексна
Тотьма
Череповец
Воронежская область
Воронеж
Забайкальский край
Чита
Ивановская область
Иваново
Шуя
Иркутская область
Ангарск
Иркутск
Шелехов
Кабардино-Балкаарская Республика
Баксан
Нальчик
Калининградская область
Калининград
Калужская область
Кемеровская область
Кемерово
Новокузнецк
Кировская область
Киров
Кирово-Чепецк
Костромская область
Кострома
Краснодарский край
Адлер
Адыгея
Краснодар
Курганинск
Сочи
Красноярский край
Красноярск
Курганская область
Курган
Шадринск
Курская область
Курск
Мурманская область
Апатиты
Кандалакша
Мурманск
Нижегородская область
Нижний Новгород
Новгородская область
Боровичи
Великий Новгород
Старая Русса
Новосибирская область
Новосибирск
Омская область
Омск
Оренбургская область
Бузулук
Новотроицк
Оренбург
Орск
Пензенская область
Пенза
Пермский край
Пермь
Приморский край
Артем
Владивосток
Находка
Псковская область
Великие Луки
Псков
Республика Башкортостан
Бирск
Красноусольский
Кумертау
Нефтекамск
Октябрьский
Салават
Стерлитамак
Уфа
Республика Беларусь
Минск
Республика Бурятия
Улан-Удэ
Республика Дагестан
Махачкала
Республика Казахстан
Астана
Республика Карелия
Костомукша
Петрозаводск
Сегежа
Сортавала
Республика Коми
Сыктывкар
Республика Крым
Севастополь
Симферополь
Республика Мордовия
Саранск
Республика Татарстан
Казань
Набережные Челны
Республика Чувашия
Чебоксары
Ростовская область
Аксай
Батайск
г. Каменск-Шахтинский
Каменск-Шахтинский
Новочеркасск
Ростов-на-Дону
Рязанская область
Рязань
Самарская область
Кинель
п. Волжский (Царевщина)
п. Стройкерамика
Похвистнево
Самара
Тольятти
Ульяновск
Саратовская область
Саратов
Сахалинская область
Южно-Сахалинск
Свердловская область
Екатеринбург
Нижний Тагил
Ставропольский край
Михайловск
Невинномысск
Ставрополь
Тверская область
Тверь
Тульская область
Тула
Тюменская область
Тобольск
Тюмень
Ялуторовск
Ульяновская область
Ульяновск
Хабаровский край
Хабаровск
Ханты-Мансийский АО (Югра)
Сургут
Челябинская область
Челябинск
Читинская область
Чита
Ярославская область
Ярославль
Специальные добавки для зимней стройки
Существует мнение о том, что зимний период — не хорошее время для строительства, и оно верно. Зимние условия диктуют целый ряд ограничений. Необходимо установить обогрев строительной площадки и бытовки для служащих и рабочих, чистить от снега подъездную дорогу. В связи с коротким световым днем срок строительства увеличивается.
Зимние условия диктуют целый ряд ограничений. Необходимо установить обогрев строительной площадки и бытовки для служащих и рабочих, чистить от снега подъездную дорогу. В связи с коротким световым днем срок строительства увеличивается.
Все таки дом строить зимой можно. Не запрещают это и нормативы. Также снижается стоимость услуг строительных бригад и цена строительных материалов в холодное время.
В холодные месяцы производят кладку стен из таких стеновых материалов, как ракушечник, кирпич, бутовый камень, газо-, керамо- и пеноблоки, возводят стены монолитные стены из бетона. Также можно использовать метод несъемной опалубки и производить штукатурные работы.
Но есть проблема. Вода, используемая для затворения строительных смесей, замерзает и не взаимодействуют с другими химическими веществами.
Поэтому, если температура упала ниже 0°С твердение готового раствора заканчивается. А лед образованный значительно разрушает структуру раствора, существенно снижая его прочность.
Для этого в зимнее время года нужно обязательно добавлять противоморозные добавки к строительным смесям или покупать готовые «зимние» составы.
Используем противоморозные добавкиПроблему готовности растворов к применению в морозную погоду решают несколькими способами. Но чаще всего в состав строительных смесей вводят противоморозные добавки — специальные соли, которые снижают температуру замерзания воды и предотвращают ее превращение в лед. Делают это непосредственно на строительной площадке. В итоге растворный шов успевает набрать достаточную прочность до того, как вода замерзнет. С этой целью используют такие добавки, как углекислый калий (поташ), азотистокислый натрий (нитрит натрия), хлористый кальций, хлористый натрий, формиат натрия и др.
При строительстве коттеджа для проведения работ при температуре до -15 °С специалисты советуют выбирать в качестве добавки нитрит или формиат натрия. Если похолодало еще сильнее, нужно использовать поташ (до -30 °С). Преимущество всех вариантов — отсутствие коррозии при возведении армированных конструкций. Не появляются и высолы на поверхности затвердевшего раствора. А вот хлорсодержащие вещества лучше не использовать — они ускоряют коррозионные процессы, что приводит к разрушению армирующих деталей.
Преимущество всех вариантов — отсутствие коррозии при возведении армированных конструкций. Не появляются и высолы на поверхности затвердевшего раствора. А вот хлорсодержащие вещества лучше не использовать — они ускоряют коррозионные процессы, что приводит к разрушению армирующих деталей.
Правда, что поташ, что нитрит натрия — опасные и ядовитые материалы. Итоговые цементные или бетонные растворы не наносят вред здоровью человека, но при применении этих добавок нужно соблюдать технику безопасности: хранить вещества в сухом и запираемом помещении в заводской упаковке, а растворы готовить в очках, резиновых перчатках, сапогах и строительных комбинезонах. С формиатом натрия работать проще, поскольку он не является токсичным веществом.
Очень важно соблюдать рекомендованные производителем пропорции при приготовлении состава. Обычно они зависят от температуры окружающего воздуха. Усредненные цифры приведены в таблице.
| Температура воздуха,°С | Расход добавок,% от массы цемента в смеси | ||
| Поташ | Нитрит натрия | Формиат натрия | |
| -5°С | 5-6 | 4-6 | 2-3 |
| -10°С | 6-8 | 6-8 | 3-4 |
| -15°С | 8-10 | 8-10 | 4-5 |
Кроме противоморозных добавок (условно говоря, «антифризов»), существуют пластификаторы (или суперпластификаторы). Они увеличивают пластичность растворной смеси и тем самым дают возможность снизить требуемое для затворения количество воды. Пластификаторы улучшают морозостойкость раствора и увеличивают его плотность. В связи с этим как минимум несколько дней после укладки в растворе не происходит никаких физических изменений, и он успевает схватиться.
Они увеличивают пластичность растворной смеси и тем самым дают возможность снизить требуемое для затворения количество воды. Пластификаторы улучшают морозостойкость раствора и увеличивают его плотность. В связи с этим как минимум несколько дней после укладки в растворе не происходит никаких физических изменений, и он успевает схватиться.
Применение этих добавок полезно при изготовлении растворов для ведения кладки, выполнения бетонных работ, устройства наливных полов. Вводят пластифицирующие вещества вместе с водой, их минимальное количество должно составлять 5-10 % от веса цемента. Такая пропорция достаточна для проведения кладки. При необходимости бетонирования нужно увеличить расход пластификатора до 10-15 %. Тем самым будет еще более увеличена пластичность смеси при укладке и одновременно влагостойкость готового бетона.
Наконец, есть и такие зимние добавки, как специальные составы, ускоряющие процесс твердения раствора (набора прочности). Благодаря им он превращается в крепкий камень прежде, чем успевает замерзнуть. Подобные добавки пригодятся, прежде всего, для создания монолитных конструкций (бетонных перекрытий, стен по технологии несъемной опалубки). Их расход обычно составляет 2-5 % от массы цемента.
Подобные добавки пригодятся, прежде всего, для создания монолитных конструкций (бетонных перекрытий, стен по технологии несъемной опалубки). Их расход обычно составляет 2-5 % от массы цемента.
Но наиболее оптимально применение двух или нескольких видов добавок одновременно. Исключение составляют штукатурные смеси. В них лучше вводить только «антифризы». А пластификаторы для таких составов вовсе противопоказаны, иначе они просто стекут вниз со стены после нанесения, так и не успев должным образом схватиться.
Зато в раствор для кладки стен из кирпича или крупных блоков лучше добавить одновременно противоморозные добавки и пластификаторы. Для бетона пригодятся ускорители твердения в сочетании с пластификаторами. Можно совместить и все три вида добавочных веществ. При этом следует обязательно учесть принципиальную возможность их совместного использования без потери качества. Информацию об этом можно найти в инструкции от производителя.
В продаже есть и готовые комбинированные добавки, сочетающие в себе два или несколько качеств.
Проводить бетонные работы в зимнее время (например возводить стены по методу бетонной опалубки или заливать монолитное перекрытие) специалисты рекомендуют при температуре воздуха не ниже -10 «С. При более сильных морозах бетонирование лучше временно прекратить. «Свежую» конструкцию надо накрыть рубероидом, полиэтиленовой пленкой или минеральной ватой на несколько дней, пока бетон надежно не схватится.
Бетономешалка подойдет, если рабочих много или готовый раствор можно хранить в отапливаемом помещении
Раствор, оставленный на открытом воздухе, рискует быстро замерзнуть и прийти в негодность
В противном случае смесь стоит готовить небольшими порциями
Готовые противоморозные составыКроме комбинированных добавок, производители предлагают и готовые сухие смеси, в которые уже в заводских условиях были добавлены те или иные противоморозные добавки. Они бывают двух видов: кладочные и отделочные. Первые, в свою очередь, подразделяют на тяжелые (с плотностью более 1500 кг/ м3) и легкие (плотность, соответственно, менее 1500 кг/м3). В продаже есть как простые растворы (на основе цемента или извести), так и сложные (цементно-известковые). Для кладки применяют цементные или цементно-известковые тяжелые растворы.
Они бывают двух видов: кладочные и отделочные. Первые, в свою очередь, подразделяют на тяжелые (с плотностью более 1500 кг/ м3) и легкие (плотность, соответственно, менее 1500 кг/м3). В продаже есть как простые растворы (на основе цемента или извести), так и сложные (цементно-известковые). Для кладки применяют цементные или цементно-известковые тяжелые растворы.
Использовать готовые растворы, конечно, куда удобнее, чем готовить замес самостоятельно: нет необходимости тщательно контролировать количество, учитывать сочетаемость материалов и т. д. Кладка кирпичей и блоков на готовые растворные смеси позволяет стене за зиму набрать до 8о % необходимой прочности, что сравнимо с результатами летней кладки. Кстати, есть и «фирменные» сухие смеси. Например, свои составы предлагают многие производители газобетонных блоков.
Но за удобство следует платить — такие растворы стоят существенно дороже, чем обычные. Зато в их составе находятся химические вещества в многократно выверенных пропорциях, и все, что требуется — просто развести их чистой водой (предварительно подогретой до 30-40 °С) и перемешать (при помощи дрели с миксером). Готовый раствор должен быть в меру пластичным, не должен растекаться и быть слишком густым. Использовать смесь нужно в течение часа с момента приготовления. Причем следует следить, чтобы температура самого раствора не упала ниже нуля. Замерзшую смесь придется выбросить: использовать отогретый раствор (такие советы встречаются) специалисты категорически не рекомендуют.
Готовый раствор должен быть в меру пластичным, не должен растекаться и быть слишком густым. Использовать смесь нужно в течение часа с момента приготовления. Причем следует следить, чтобы температура самого раствора не упала ниже нуля. Замерзшую смесь придется выбросить: использовать отогретый раствор (такие советы встречаются) специалисты категорически не рекомендуют.
Первое условие при возведении стен в холодный период — перед укладкой кирпич или блок обязательно должны быть очищены от снега, льда или инея. Второе важное правило — цемент и готовую смесь нужно хранить в утепленных емкостях. Причем отогревать слегка схватившийся раствор нельзя. Поэтому очень важно обеспечить высокую скорость кладки и быстрое уплотнение нижележащих рядов верхними. А в перерывах желательно укрывать готовую часть стены фанерой, рубероидом или пленкой. Или же тщательно очищать поверхность от снега и инея при возобновлении работ.
Раствор при отрицательных температурах готовят в отапливаемых помещениях, причем используют цемент марки М50 и более. В песке не допускается наличие крупных комков (более 1 см) и кусочков льда.
В песке не допускается наличие крупных комков (более 1 см) и кусочков льда.
Кладку при помощи зимних растворов необходимо вести с тонкими швами порядка 1-3 мм (то есть такими же, как и в летнее время). Это требование связано с тем, что большие швы увеличивают теплопотери конструкции и могут привести к значительной осадке весной. Также во время работы следует с особой тщательностью проверять вертикальность стен: любые отклонения тоже чреваты проблемами во время оттепели. Кладку ведут равномерно, по всему периметру здания или длине стены так, чтобы не было больших перепадов по высоте. Столбы и простенки между оконными проемами армируют при помощи стальных сеток.
Наконец, весной, в период оттаивания, необходимо контролировать прочность и устойчивость стены, выполненной зимой. Ведь при повышении температуры кладка также оттаивает, могут возникнуть небольшие осадочные явления и микротрещины. Поэтому, как и во время кладки, следует каждые 2-3 дня проверять сохранение вертикальности конструкций, а при обнаружении минимального отклонения нужно сразу же установить подкосы и опоры из деревянных бревен или металлических труб, которые предотвратят дальнейшее смещение.![]() Обычно это требуется для стен, расположенных с южной стороны. Их на время оттепели можно завесить (например пергамином). После того как в течение 7-10 дней будет поддерживаться круглосуточно положительная температура, опорные элементы убирают.
Обычно это требуется для стен, расположенных с южной стороны. Их на время оттепели можно завесить (например пергамином). После того как в течение 7-10 дней будет поддерживаться круглосуточно положительная температура, опорные элементы убирают.
Еще один способ борьбы с неравномерной осадкой — предварительная монтаж опорных элементов и принудительное оттаивание стены во время ранней весны при помощи калориферов, электрообогревателей или тепловых пушек, располагаемых внутри здания. Для этого необходимо поднять температуру в помещении до 30°С и поддерживать ее в течение нескольких дней. Однако этот способ более трудоемкий, требует немалых энергозатрат, наличия надежного подключения к электросети рядом с домом или использования автономных генераторов.
При зимней кладке особенно важно соблюдать толщину раствора и выдерживать уровень
Несоблюдение правил подготовки растворов и кладки как минимум приведет к образованию высолов, а как максимум — к появлению трещин
В перерывах между работой нужно закрывать свежую кладку
Штукатурные работы в холодВыполнять зимой наружные отделочные работы для вновь возведенной стены специалисты не рекомендуют. Этот процесс лучше перенести на весну, причем на то время, когда построенная конструкция полностью оттает. При этом вести оштукатуривание готовых фасадов, устроенных летом или осенью (например из газоблоков или керамического кирпича), можно. А вот в том случае, если предполагается фасадное утепление, работы по его отделке, а также нанесению финишного штукатурного состава лучше перенести на весну.
Этот процесс лучше перенести на весну, причем на то время, когда построенная конструкция полностью оттает. При этом вести оштукатуривание готовых фасадов, устроенных летом или осенью (например из газоблоков или керамического кирпича), можно. А вот в том случае, если предполагается фасадное утепление, работы по его отделке, а также нанесению финишного штукатурного состава лучше перенести на весну.
Поверхность перед оштукатуриванием необходимо тщательно отчистить от грязи, снега, наледи и инея. Все слои штукатурки следует нанести в течение одного дня, выполняя следующий сразу после того, как слегка загустеет предыдущий.
Главное — не забывать добавлять в состав противоморозные добавки. Вводить «антифризы» нужно уже в том случае, если температура наружного воздуха опустилась ниже 5 °С. Ни в коем случае нельзя применять старые, давно хранившиеся смеси или составы. Ведь результат будет, что называется, налицо — в виде высолов и подтеков на поверхности стены.
Древнерусский раствор оказался лучше современного цемента
Древнерусский строительный раствор оказался по нескольким параметрам лучше, чем современный цемент. Подробностями строительства крепостей на Руси в XVI-XVII веках руководитель исследования поделился с корреспондентом Infox.ru.
Подробностями строительства крепостей на Руси в XVI-XVII веках руководитель исследования поделился с корреспондентом Infox.ru.
Российские историки уже давно занимаются изучением истории и техники древнерусского строительства. Как пояснил корреспонденту Infox.ru кандидат исторических наук Константин Носов из Российской академии государственной службы при президенте РФ в Москве, «все каменные или кирпичные сооружения на Руси строились с использованием специального строительного раствора». Изучение состава этого раствора помогает ученым не только понять методику строительства, но и точнее датировать архитектурный памятник, создать похожий раствор для проведения реставрационных работ, определить, где именно добывались составляющие раствора, и отнести архитектурный памятник к определенной строительной школе.
Впервые этим вопросом историки занялись еще в 1930 году, однако до сих пор про растворы известно немного. По словам Носова, дело в том, что до настоящего времени ученые использовали каждый свой метод анализа, да и обработали небольшое количество образцов. В основном исследователей интересовали домонгольские сооружения: ученые исследовали около 90 древнерусских памятников, из которых 70 датируются XI-XIII веками.
В основном исследователей интересовали домонгольские сооружения: ученые исследовали около 90 древнерусских памятников, из которых 70 датируются XI-XIII веками.
13 образцов на анализ
Команда российских ученых под руководством Носова решила провести комплексный анализ образцов раствора более позднего периода. Ученый лично взял 13 образцов строительных растворов русских крепостей XVI-XVII веков в Нижнем Новгороде, Коломне, Зарайске, Серпухове, Борисовом городке, Смоленске и Вязьме. Для сравнения он также изучил образцы современного раствора в Смоленске и средневековых укреплений в Англии и в Уэльсе (замок в Чепстоу, городские стены в Конуи и в Кембере). Сложность работы заключалась в том, чтобы найти тот участок крепости, где не проводились реставрации и не применялись более поздние растворы (например, в случае с Московским Кремлем найти кладку конца XV века практически невозможно, так как крепость слишком часто ремонтировалась).
Рентгенофлуоресцентный анализМетод спектроскопического исследования вещества с помощью рентгеновского излучения для определения содержания элементов и элементарного состава образца вещества. Петрографический анализ — метод исследования вещества с помощью микроскопа для определения фазового состава, структуры и текстуры горной породы или технического камня.
Петрографический анализ — метод исследования вещества с помощью микроскопа для определения фазового состава, структуры и текстуры горной породы или технического камня.
Что такое строительный раствор?
Строительный раствор состоит из двух компонентов: вяжущего вещества и заполнителя. Иногда к ним подмешивают и специальные добавки. На Руси в качестве вяжущего элемента использовалась известь: известняк, мел и другие карбонатные породы обжигались в специальных печах. К полученной смеси добавляли воду, в результате чего образовывалась гашеная известь, получалось этакое строительное «тесто». Однако такой материал быстро трескался. Поэтому к извести добавляли заполнитель, например песок, значительно улучшавший качество строительного раствора.
Ученые определили прочность разных строительных растворов, процентное соотношение вяжущего элемента и заполнителя, их состав и дополнительные примеси (например обломки кирпича или кирпичная мука, шлак, раковины и т. д.).
Как и из чего строили в XVI веке?
ЦемянкаЗаполнитель для строительного раствора из керамической или кирпичной крошки. Использовался, например, при строительстве архитектурных памятников Киева, Чернигова, Переяславля.
В итоге ученые выяснили, что строительные смеси, связывающие камни крепостей XVI-XVII веков, значительно отличаются от более ранних образцов. В XI-XIII веках в основном использовали известково-цемяночные, а в XVI-XVII — известково-песчаные смеси. В некоторых образцах присутствует недожженная известь, которая повышает прочность раствора. Возможно, древние строители специально не очищали известь, выяснив экспериментальным путем, что так качество раствора только повышается. Исследователи также нашли следы повторного использования старой извести, которую смешивали с новой. Более того, они обнаружили, что некоторые качества древней извести (долговечность, воздухоустойчивость) превышают качества современных цементов.
Более того, они обнаружили, что некоторые качества древней извести (долговечность, воздухоустойчивость) превышают качества современных цементов.В Смоленске Носов брал четыре образца раствора из разных мест. Оказалось, что их составы довольно сильно отличаются между собой. Как пояснил ученый корреспонденту Infox.ru, видимо, у древних мастеров не было устоявшейся рецептуры приготовления этого вещества, и каждый раз получалось по-разному.
Образец современного раствора, использованный реставраторами, оказался весьма похож на древнерусский, однако оказался плохо перемешан. Зато средневековые образцы из Уэльса и Англии очень похожи на русские растворы XVI-XVII веков.
Несмотря на все полученные данные, ученым еще предстоит выполнить большую работу, чтобы сделать выводы об общей эволюции строительных растворов на Руси и их использовании в культовых, военных и гражданских сооружениях. По словам Носова, также интересно было бы сравнить древнерусские растворы с итальянскими, так как в Россию приезжали и иностранные мастера, например Аристотель Фиораванти (примерно 1415—1486), который построил Успенский собор в Москве.
Статья об исследовании строительных растворов русских крепостей XVI-XVII веков опубликована в журнале «Российская археология» (№ 1, 2009).
Народные добавки в бетон и раствор для увеличения прочности
Народные добавки в бетон и раствор
Содержание статьи:
Чтобы улучшить прочностные показатели бетона и не только, существуют различные добавки и пластификаторы. Но ещё задолго до их появления, мастера знали народные средства, которые ничуть не хуже, а может, где-то даже и лучше, позволяли увеличить прочность бетона, повысить его морозостойкость и водоотталкивающие свойства.Недаром же ходит много споров и вопросов о том, зачем добавляли соль и куриное яйцо в бетон, глину, а также различные другие средства. В этом обзоре строительного журнала samastroyka.ru будет рассказано исключительно про «народные» добавки в бетон, какие они существуют, и что собственно дают.
Зачем добавляют куриные яйца и глину в бетон?
Издавна при строительстве храмов в раствор добавляли куриное яйцо, и это факт. Конечно же, состав тогдашнего строительного раствора существенно отличался от сегодняшнего. В нем больше присутствовало извести, раствору из которой, собственно говоря, и придавали прочность куриные яйца.
Конечно же, состав тогдашнего строительного раствора существенно отличался от сегодняшнего. В нем больше присутствовало извести, раствору из которой, собственно говоря, и придавали прочность куриные яйца.
Однако, уже доказано, и факт остается фактом, что при добавлении в бетон и цементный раствор куриных яиц, тем самым, можно существенно улучшить прочность, плотность, сцепляющие свойства и водонепроницаемость строительной смеси. Многие из тех построек, которые возводились с использованием извести, куриных яиц и неорганических добавок, стоят и по сей день, удивляя своей небывалой прочностью. Что уж тут говорить, наши предки знали толк в строительстве, и им не нужны были суперпластификаторы для этих целей.
Второй компонент, который использовался задолго до появления цемента, это глина, которая придавала строительному раствору необычайной крепости. Готовилась смесь с использованием глины очень долго, однако и постройки, возведённые с её использованием, стоят до сих пор. Сегодня глину добавляют в бетон, скорее всего для удешевления строительной смеси, нежели чтобы повысить ее прочностные показатели.
Сегодня глину добавляют в бетон, скорее всего для удешевления строительной смеси, нежели чтобы повысить ее прочностные показатели.
К сожалению, бетон с добавлением глины не походит для заливки фундаментов и других элементов дома, к которым предъявляются особые требования касательно прочности и надежности.
Народные добавки в раствор и бетон для увеличения его прочности и не только
Еще одним компонентом, который позволяет существенно увеличить морозоустойчивость раствора, является техническая соль. При этом важно не переборщить при добавлении соли в бетон, её должно быть не более 2%. В противном случае, возможно, только усугубить ситуацию коррозионными процессами, которые и так воздействуют на металлические части железобетонной конструкции. В случае с растворами для кладки и отделки печей, самая обычная соль, позволяет улучшить их жаростойкость.
Активно используют при изготовлении бетонов и раствором, также и мыльные растворы с порошком. Что они дают? В первую очередь позволяют увеличить подвижность строительной смеси, сделать её более пластичной и податливой в работе. Особенно это касается цементного раствора для оштукатуривания стен, работать с ним становится намного легче и проще, если добавить при изготовлении небольшое количество жидкого мыла.
Особенно это касается цементного раствора для оштукатуривания стен, работать с ним становится намного легче и проще, если добавить при изготовлении небольшое количество жидкого мыла.
Не менее популярные при изготовлении строительных смесей на основе цемента, являются и такие добавки, как клей ПВХ и гашеная известь-пушонка. Второй компонент способен придать раствору эластичности и клейкости, улучшить сцепляющие свойства смеси и придать ей бактерицидных свойств. Раствор с добавлением извести-пушонки становится намного устойчивее против воздействия грибков и плесени.
Что же касается добавления клея ПВА в бетон, то он способен улучшить его подвижность, существенно увеличить показатели касательно прочности и водостойкости.
Оценить статью и поделиться ссылкой:Реакции в растворе — Химия LibreTexts
Раствор состоит из двух или более веществ, растворенных в жидкой форме. Не путайте со смесью , которая является гетерогенной — существует множество веществ с разной структурой — растворы гомогенны, что означает, что атомы растворенного вещества равномерно распределены по всему растворителю (например, воде, этанолу). Думайте об этом, как о сравнении чашки (растворенной) сахарной воды и чашки воды с кубиками лего. Растворенное вещество — это вещество, растворенное в растворе, а растворитель — это вещество, осуществляющее растворение.
Думайте об этом, как о сравнении чашки (растворенной) сахарной воды и чашки воды с кубиками лего. Растворенное вещество — это вещество, растворенное в растворе, а растворитель — это вещество, осуществляющее растворение.
отл.
Раствор NaCl в воде Смесь блоков лего и воды
Примечание: все растворы являются смесями, но не все смеси являются растворами.
Растворители
Вода (H 2 O) — наиболее распространенный растворитель, используемый для растворения многих соединений или приготовления кофе. Среди других распространенных растворителей — скипидар (разбавитель для краски), ацетон (жидкость для снятия лака) и этанол (используется в некоторых парфюмах).Такие растворители обычно содержат углерод и называются органическими растворителями. Растворы с водой в качестве растворителя называются водными растворами; у них есть особые свойства, о которых здесь говорится.
Растворы
Различные химические соединения растворяются в растворенных веществах в разной степени. Некоторые соединения, такие как сильнокислая соляная кислота (HCl), полностью диссоциируют в растворе на ионы. Другие, такие как слабый щелочной аммиак (NH 3 ), диссоциируют лишь частично. Однако другие соединения, такие как спирт, вообще не диссоциируют и остаются соединениями.В лабораторных реакциях часто используются кислоты и основания, о которых здесь подробнее рассказывается.
Некоторые соединения, такие как сильнокислая соляная кислота (HCl), полностью диссоциируют в растворе на ионы. Другие, такие как слабый щелочной аммиак (NH 3 ), диссоциируют лишь частично. Однако другие соединения, такие как спирт, вообще не диссоциируют и остаются соединениями.В лабораторных реакциях часто используются кислоты и основания, о которых здесь подробнее рассказывается.
Концентрация
Концентрация — это мера количества растворенного вещества в определенном количестве растворителя. Знание концентрации раствора важно, помимо прочего, для определения силы кислоты или основания (pH). Когда в концентрации присутствует так много растворенного вещества, что оно больше не растворяется, раствор становится насыщенным.
Ученые часто используют молярность для измерения концентрации.
молярность = моль / литр
Поскольку стехиометрия реакции зависит от молярных соотношений, молярность является основным показателем концентрации.
Менее распространенная единица измерения концентрации называется моляльностью .
Моляльность = моль / кг растворителя
Ученые иногда используют молярность для измерения концентрации, потому что объемы жидкости незначительно меняются в зависимости от температуры и давления. Однако масса остается неизменной, и ее можно точно измерить с помощью весов.Коммерческие концентрированные продукты обычно выражаются в массовых процентах; такие как промышленная концентрированная серная кислота, которая составляет 93-98% H 2 SO 4 по массе в воде (Hill, Petrucci 116).
Принятие решения
Растворы, используемые в лаборатории, обычно изготавливаются либо из твердых растворенных веществ (часто солей), либо из исходных растворов.
Чтобы приготовить раствор из твердых растворенных веществ, сначала вычислите, сколько молей растворенного вещества находится в желаемых растворах (используя молярность).Вычислите необходимое количество твердого вещества в граммах, используя необходимые моли и молярную массу растворенного вещества, и взвесьте необходимое количество. Перенесите растворенное вещество в контейнер (желательно в мерную колбу, которая наиболее точно измеряет объем раствора, указанный на колбе) и добавьте небольшое количество растворителя. Тщательно перемешайте до растворения растворенного вещества. После растворения растворенного вещества добавьте оставшийся растворитель, чтобы получить раствор желаемого объема, и тщательно перемешайте.
Перенесите растворенное вещество в контейнер (желательно в мерную колбу, которая наиболее точно измеряет объем раствора, указанный на колбе) и добавьте небольшое количество растворителя. Тщательно перемешайте до растворения растворенного вещества. После растворения растворенного вещества добавьте оставшийся растворитель, чтобы получить раствор желаемого объема, и тщательно перемешайте.
Например, чтобы сделать 0.5 литров 0,5 молярного NaCl:
1. Умножьте концентрацию (0,5 моль / литр) на объем раствора, который вам нужен (0,5 литра), чтобы найти нужное количество молей NaCl.
0,5 моль / литр * 0,5 литра = 0,25 моль NaCl
2. Умножьте моли NaCl на его молярную массу (58,44 г / моль), чтобы найти необходимые граммы растворенного вещества.
(0,25 моль NaCl) * (58,44 г / моль) = 14,61 г NaCl
Приготовление раствора определенной концентрации из основного раствора называется разбавлением.При разбавлении раствора имейте в виду, что добавление растворителя в раствор изменяет концентрацию раствора, но не количество уже присутствующего растворенного вещества.
Используемое уравнение — просто
M 1 V 1 = M 2 V 2
M 1 и V 1 — концентрация и объем исходного (исходного) раствора для разбавления; M 2 и V 2 — желаемая концентрация и объем конечного раствора.
Стехиометрия раствора
Для реакций, протекающих в растворах:
- Рассчитайте количество молей растворенного вещества в реакции, умножив концентрацию (молярность) на объем раствора (литры)
- Определите предельный реагент, если он один
- Следуйте стехиометрическому процессу.
- Преобразуйте полученные моль растворенного вещества обратно в молярность, разделив на общий объем в литрах раствора, использованного в реакции.

- В случае реакций с участием ионов (например, в реакциях между сильными кислотами и основаниями) исключить ионы-наблюдатели из общего ионного уравнения. Ионы-наблюдатели в уравнениях не реагируют.
- Если концентрация не указана, но указаны молярная масса и объем, используйте плотность (граммы / литр), чтобы найти количество растворенного вещества в граммах, затем преобразуйте его в моль.
Список литературы
- Хилл, Петруччи. Общая химия: комплексный подход, второе издание.Нью-Джерси: Прентис-Холл, 1999.
- Петруччи, Харвуд, Селедка, Мадура. Общая химия: принципы и современные приложения, девятое издание. Нью-Джерси: Прентис-Холл, 2007.
Проблемы
- Раствор готовят растворением 44,6 г ацетона (OC (CH 3 ) 2 ) в воде с получением 1,50 л раствора. Какая молярность полученного раствора?
- Для определенной лабораторной процедуры требуется 0,025 M H 2 SO 4 .
 Сколько миллилитров 1,10 M H 2 SO 4 следует разбавить водой, чтобы приготовить 0,500 л 0,025 M H 2 SO 4 ?
Сколько миллилитров 1,10 M H 2 SO 4 следует разбавить водой, чтобы приготовить 0,500 л 0,025 M H 2 SO 4 ? - Образец насыщенного NaNO 3 (водн.) Имеет размер 10,9 M при 25 градусах Цельсия. Сколько граммов NaNO 3 содержится в 230 мл этого раствора при той же температуре?
- Стакан с 175 мл 0,950 М NaCl оставляют открытым на некоторое время. Если к концу периода времени объем раствора в химическом стакане уменьшился до 137 мл (потеря объема происходит из-за испарения воды), какова результирующая концентрация раствора?
- Студент готовит раствор, растворяя 15.0 мл этанола (C 2 H 5 OH) в воде с получением 300,0 мл раствора. Рассчитайте концентрацию (молярность) этанола в растворе. (плотность = 0,789 г / мл)
Авторы и авторство
8.1: Концентрации растворов — Chemistry LibreTexts
Результаты обучения
- Определите концентрацию.

- Используйте термины «концентрированный» и «разбавленный» для описания относительной концентрации раствора.
- Рассчитайте молярность раствора.
- Рассчитайте процентную концентрацию (м / м, об / об, м / об).
- Опишите раствор, концентрация которого указана в \ (\ text {ppm} \) или \ (\ text {ppb} \).
- Использовать в расчетах единицы концентрации.
- Определите эквиваленты иона.
- Завершите вычисления, относящиеся к молям, объемам или массе.
- Завершите расчет разбавления.
Есть несколько способов выразить количество растворенного вещества, присутствующего в растворе.Концентрация раствора является мерой количества растворенного вещества, которое было растворено в данном количестве растворителя или раствора . Концентрированный раствор — это раствор, содержащий относительно большое количество растворенного вещества. Разбавленный раствор — это раствор, содержащий относительно небольшое количество растворенного вещества . Однако эти термины относительны, и нам нужно иметь возможность выразить концентрацию более точным, количественным образом.Тем не менее, «концентрированный» и «разбавленный» полезны как термины для сравнения одного раствора с другим (см. Рисунок ниже). Также имейте в виду, что термины «концентрировать» и «разбавлять» могут использоваться как глаголы. Если бы вы нагревали раствор, вызывая испарение растворителя, вы бы концентрировали его, потому что соотношение растворенного вещества к растворителю увеличивалось бы. Если бы вы добавили больше воды в водный раствор, вы бы разбавили его, потому что отношение растворенного вещества к растворителю уменьшилось бы.
Разбавленный раствор — это раствор, содержащий относительно небольшое количество растворенного вещества . Однако эти термины относительны, и нам нужно иметь возможность выразить концентрацию более точным, количественным образом.Тем не менее, «концентрированный» и «разбавленный» полезны как термины для сравнения одного раствора с другим (см. Рисунок ниже). Также имейте в виду, что термины «концентрировать» и «разбавлять» могут использоваться как глаголы. Если бы вы нагревали раствор, вызывая испарение растворителя, вы бы концентрировали его, потому что соотношение растворенного вещества к растворителю увеличивалось бы. Если бы вы добавили больше воды в водный раствор, вы бы разбавили его, потому что отношение растворенного вещества к растворителю уменьшилось бы.
Процентная концентрация
Один из способов описать концентрацию раствора — это процент раствора, который состоит из растворенного вещества. Это процентное содержание может быть определено одним из трех способов: (1) масса растворенного вещества, деленная на массу раствора, (2) объем растворенного вещества, деленный на объем раствора, или (3) масса растворенного вещества, растворенное вещество, деленное на объем раствора. Поскольку эти методы обычно приводят к немного разным значениям, важно всегда указывать, как был рассчитан данный процент.
Это процентное содержание может быть определено одним из трех способов: (1) масса растворенного вещества, деленная на массу раствора, (2) объем растворенного вещества, деленный на объем раствора, или (3) масса растворенного вещества, растворенное вещество, деленное на объем раствора. Поскольку эти методы обычно приводят к немного разным значениям, важно всегда указывать, как был рассчитан данный процент.
Массовый процент
Когда растворенное вещество в растворе является твердым веществом, удобный способ выразить концентрацию — это массовый процент (масса / масса), который представляет собой граммы растворенного вещества на \ (100 \: \ text {g} \) раствора.
\ [\ text {Массовый процент} = \ frac {\ text {масса растворенного вещества}} {\ text {масса раствора}} \ times 100 \% \]
Предположим, что раствор был приготовлен растворением \ (25.0 \: \ text {g} \) сахара в \ (100 \: \ text {g} \) воды. Массовый процент рассчитывается следующим образом:
\ [\ text {Процент по массе} = \ frac {25 \: \ text {g сахара}} {125 \: \ text {g solution}} \ times 100 \% = 20 \% \: \ text {сахар } \]
Иногда вам может потребоваться приготовить определенное количество раствора с определенным массовым процентом, и вам нужно будет рассчитать, какая масса растворенного вещества необходима. 3 \: \ text {g} \ right) \), чтобы вычислить массу воды, которую необходимо добавить.
3 \: \ text {g} \ right) \), чтобы вычислить массу воды, которую необходимо добавить.
Объем в процентах
Процент растворенного вещества в растворе легче определить по объему, если растворенное вещество и растворитель являются жидкостями. Объем растворенного вещества, деленный на объем раствора, выраженный в процентах, дает процент по объему (объем / объем) раствора. Если раствор приготовлен путем взятия \ (40. \: \ Text {mL} \) этанола и добавления воды, достаточной для получения \ (240.\: \ text {mL} \) раствора объемный процент:
\ [\ begin {align} \ text {Процент по объему} & = \ frac {\ text {объем растворенного вещества}} {\ text {объем раствора}} \ times 100 \% \\ & = \ frac {40 \: \ text {мл этанола}} {240 \: \ text {мл раствора}} \ times 100 \% \\ & = 16,7 \% \: \ text {этанол} \ end {align} \]
Часто на этикетках ингредиентов пищевых продуктов и лекарств указано количество в процентах (см. Рисунок ниже).
Рисунок \ (\ PageIndex {2} \): Перекись водорода обычно продается в виде раствора с концентрацией \ (3 \% \) по объему для использования в качестве дезинфицирующего средства.
Следует отметить, что, в отличие от массы, нельзя просто сложить вместе объемы растворенного вещества и растворителя, чтобы получить конечный объем раствора. При добавлении растворенного вещества и растворителя масса сохраняется, а объем — нет. В приведенном выше примере раствор был приготовлен путем добавления \ (40 \: \ text {mL} \) этанола и добавления воды, достаточной для приготовления \ (240 \: \ text {mL} \) раствора. Простое смешивание \ (40 \: \ text {mL} \) этанола и \ (200 \: \ text {mL} \) воды не даст вам того же результата, поскольку конечный объем, вероятно, будет не совсем \ ( 240 \: \ text {mL} \).
Массово-объемный процент также используется в некоторых случаях и рассчитывается аналогично предыдущим двум процентам. Массовый / объемный процент рассчитывается путем деления массы растворенного вещества на объем раствора и выражения результата в процентах.
Например, если раствор приготовлен из \ (10 \: \ ce {NaCl} \) в достаточном количестве воды, чтобы приготовить раствор \ (150 \: \ text {mL} \), массово-объемная концентрация составит
\ [\ begin {align} \ text {Массово-объемная концентрация} & \ frac {\ text {масса растворенного вещества}} {\ text {volume solution}} \ times 100 \% \\ & = \ frac {10 \: \ text {g} \: \ ce {NaCl}} {150 \: \ text {мл раствор}} \ times 100 \% \\ & = 6. 7 \% \ end {align} \]
7 \% \ end {align} \]
Частей на миллион и частей на миллиард
Две другие единицы концентрации — части на миллион и части на миллиард. Эти единицы используются для очень малых концентраций растворенных веществ, таких как количество свинца в питьевой воде. Понять эти две единицы будет намного проще, если вы будете рассматривать процент как доли на сотню. Помните, что \ (85 \% \) эквивалентно 85 из ста. Раствор \ (15 \: \ text {ppm} \) состоит из 15 частей растворенного вещества на 1 миллион частей раствора.Решение \ (22 \: \ text {ppb} \) — это 22 части растворенного вещества на миллиард частей раствора. Хотя существует несколько способов выражения двух единиц \ (\ text {ppm} \) и \ (\ text {ppb} \), мы будем рассматривать их как \ (\ text {mg} \) или \ (\ mu \ текст {g} \) растворенных веществ на решение \ (\ text {L} \) соответственно.
Например, \ (32 \: \ text {ppm} \) можно записать как \ (\ frac {32 \: \ text {mg solute}} {1 \: \ text {L solution}} \), а \ (59 \: \ text {ppb} \) можно записать как \ (\ frac {59 \: \ mu \ text {g solute}} {1 \: \ text {L solution}} \).
Молярность
Химики в первую очередь нуждаются в выражении концентрации растворов таким образом, чтобы учитывать количество присутствующих частиц, которые могут реагировать в соответствии с определенным химическим уравнением. Поскольку процентные измерения основаны либо на массе, либо на объеме, они обычно не используются для химических реакций. Предпочтительна единица концентрации, основанная на молях. Молярность \ (\ left (\ text {M} \ right) \) раствора — это количество молей растворенного вещества, растворенного в одном литре раствора .Чтобы вычислить молярность раствора, вы разделите количество молей растворенного вещества на объем раствора, выраженный в литрах.
\ [\ text {Молярность} \: \ left (\ text {M} \ right) = \ frac {\ text {моль растворенного вещества}} {\ text {литры раствора}} = \ frac {\ text {моль }} {\ text {L}} \]
Обратите внимание, что объем указан в литрах раствора, а не в литрах растворителя. Когда указывается молярность, единицей измерения является символ \ (\ text {M} \), который читается как «молярный». Например, решение, обозначенное как \ (1.5 \: \ text {M} \: \ ce {NH_3} \), имеет значение «1.5-молярный раствор аммиака ».
Когда указывается молярность, единицей измерения является символ \ (\ text {M} \), который читается как «молярный». Например, решение, обозначенное как \ (1.5 \: \ text {M} \: \ ce {NH_3} \), имеет значение «1.5-молярный раствор аммиака ».
Пример \ (\ PageIndex {1} \)
Раствор готовится путем растворения \ (42.23 \: \ text {g} \) of \ (\ ce {NH_4Cl} \) в воде, достаточной для получения \ (500.0 \: \ text {mL} \) раствора. Рассчитайте его молярность.
Решение
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известный
- Масса \ (\ ce {NH_4Cl} = 42,23 \: \ text {g} \)
- Молярная масса of \ (\ ce {NH_4Cl} = 53.50 \: \ text {г / моль} \)
- Объем раствора \ (= 500.0 \: \ text {mL} = 0.5000 \: \ text {L} \)
Неизвестно
- Молярность \ (=? \: \ Text {M} \)
Сначала переводят массу хлорида аммония в моль. Затем молярность рассчитывается путем деления на литры. Обратите внимание, что данный объем был преобразован в литры.
Затем молярность рассчитывается путем деления на литры. Обратите внимание, что данный объем был преобразован в литры.
Шаг 2: Решить.
\ [42.23 \: \ text {g} \: \ ce {NH_4Cl} \ times \ frac {1 \: \ text {mol} \: \ ce {NH_4Cl}} {53.50 \: \ text {g} \: \ ce {NH_4Cl}} = 0,7893 \: \ text {mol} \: \ ce {NH_4Cl} \]
\ [\ frac {0.7893 \: \ text {mol} \: \ ce {NH_4Cl}} {0.5000 \: \ text {L}} = 1.579 \: \ text {M} \]
Шаг 3. Подумайте о своем результате .
Молярность равна \ (1,579 \: \ text {M} \), что означает, что литр раствора будет содержать 1,579 моль \ (\ ce {NH_4Cl} \). Уместно использовать четыре значащих цифры.
Рисунок \ (\ PageIndex {3} \): Мерные колбы бывают разных размеров, каждая из которых предназначена для приготовления разного объема раствора.Разведения
Когда к водному раствору добавляется дополнительная вода, концентрация этого раствора уменьшается. Это связано с тем, что количество молей растворенного вещества не изменяется, но общий объем раствора увеличивается. Мы можем установить равенство между молями растворенного вещества до разбавления (1) и молями растворенного вещества после разбавления (2).
Мы можем установить равенство между молями растворенного вещества до разбавления (1) и молями растворенного вещества после разбавления (2).
\ [\ text {mol} _1 = \ text {mol} _2 \]
Поскольку количество молей растворенного вещества в растворе равно молярности, умноженной на объем в литрах, мы можем установить их равными.
\ [M_1 \ раз L_1 = M_2 \ раз L_2 \]
Наконец, поскольку две части уравнения равны друг другу, объем может быть в любых единицах, которые мы выбираем, при условии, что эти единицы одинаковы для обеих сторон. Наше уравнение для расчета молярности разбавленного раствора принимает следующий вид:
\ [M_1 \ раз V_1 = M_2 \ раз V_2 \]
Кроме того, концентрация может быть в любой другой единице, если \ (M_1 \) и \ (M_2 \) находятся в одной и той же единице.
Предположим, что у вас есть \ (100.\: \ text {mL} \) раствора \ (2.0 \: \ text {M} \) \ (\ ce {HCl} \). Вы разбавляете раствор, добавляя столько воды, чтобы объем раствора составлял \ (500. \: \ Text {mL} \). Новую молярность можно легко вычислить, используя приведенное выше уравнение и решив для \ (M_2 \).
\: \ Text {mL} \). Новую молярность можно легко вычислить, используя приведенное выше уравнение и решив для \ (M_2 \).
\ [M_2 = \ frac {M_1 \ times V_1} {V_2} = \ frac {2.0 \: \ text {M} \ times 100. \: \ text {mL}} {500. \: \ text {mL}} = 0.40 \: \ text {M} \: \ ce {HCl} \]
Раствор был разбавлен в пять раз, так как новый объем в пять раз больше первоначального.Следовательно, молярность составляет одну пятую от первоначального значения. Другая распространенная проблема разбавления включает решение, сколько высококонцентрированного раствора требуется для приготовления желаемого количества раствора с более низкой концентрацией. Высококонцентрированный раствор обычно называют исходным раствором.
Пример \ (\ PageIndex {2} \)
Азотная кислота \ (\ left (\ ce {HNO_3} \ right) \) — сильнодействующая и едкая кислота. При заказе от компании-поставщика химикатов его молярность равна \ (16 \: \ text {M} \).Сколько основного раствора азотной кислоты нужно использовать для приготовления \ (8. 00 \: \ text {L} \) раствора \ (0.50 \: \ text {M} \)?
00 \: \ text {L} \) раствора \ (0.50 \: \ text {M} \)?
Решение
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известный
- Шток \ (\ ce {HNO_3} \: \ left (M_1 \ right) = 16 \: \ text {M} \)
- \ (V_2 = 8.00 \: \ text {L} \)
- \ (M_2 = 0,50 \: \ text {M} \)
Неизвестно
- Объем запасов \ (\ ce {HNO_3} \: \ left (V_1 \ right) =? \: \ Text {L} \)
Неизвестным в уравнении является \ (V_1 \), необходимый объем концентрированного основного раствора.
Шаг 2: Решить.
\ [V_1 = \ frac {M_2 \ times V_2} {V_1} = \ frac {0.50 \: \ text {M} \ times 8.00 \: \ text {L}} {16 \: \ text {M}} = 0,25 \: \ text {L} = 250 \: \ text {mL} \]
Шаг 3. Подумайте о своем результате.
\ (250 \: \ text {mL} \) исходного раствора \ (\ ce {HNO_3} \) необходимо разбавить водой до конечного объема \ (8. 00 \: \ text {L} \). Разбавление от \ (16 \: \ text {M} \) до \ (0.5 \: \ text {M} \) составляет 32 раза.
00 \: \ text {L} \). Разбавление от \ (16 \: \ text {M} \) до \ (0.5 \: \ text {M} \) составляет 32 раза.
Аналоги
Концентрация важна в здравоохранении, потому что она используется во многих отношениях.{2-}} & 2 \ end {array} \]
Используются эквиваленты, потому что концентрация зарядов важна, чем идентичность растворенных веществ. Например, стандартный раствор для внутривенного вливания не содержит тех же растворенных веществ, что и кровь, но концентрация зарядов такая же.
Иногда концентрация ниже, и в этом случае миллиэквиваленты \ (\ left (\ text {mEq} \ right) \) являются более подходящей единицей. Так же, как метрические префиксы, используемые с базовыми единицами измерения, милли используется для изменения эквивалентов, так что \ (1 \: \ text {Eq} = 1000 \: \ text {mEq} \).+} \]
Авторы и авторство
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Эллисон Султ, доктор философии (Кафедра химии, Университет Кентукки)
Ионная сила — обзор
9.
 5.3 Влияние ионной силы
5.3 Влияние ионной силыИонная сила, I , является мерой концентрации электрически заряженных частиц в растворе
(9.61) I = 12∑iciZi2
, в котором c i — концентрация иона i заряда Z i . В растворе, в котором ионная сила не равна нулю, взаимодействия между многими ионами имеют совершенно разные эффекты, чем взаимодействия между парами ионов, которые мы только что рассмотрели. Для растворов с относительно низкой ионной силой коэффициент активности иона можно оценить по теории Дебая – Хюккеля. При этом используется модель, в которой каждый ион окружен атмосферой ионов с одинаковым зарядом, но противоположной атмосфере центрального иона.Ионная атмосфера снижает химический потенциал центрального иона, нейтрализуя его заряд. Если A и B имеют заряды одного знака, высокая ионная сила способствует образованию пар столкновения с более высоким зарядом и, следовательно, увеличивает скорость реакции. Выражение теории Дебая – Хюккеля для коэффициента активности:
(9,62) logγi = −AZi2I
Параметр A в воде при 25 ° C имеет значение A = 0,51 моль −1/2 дм 3/2 .
Для реакции типа
(9.XIII) AZA + BZB → (XZA + ZB) ‡ → продукты
Ур. (9.32) дает выражение для константы скорости
(9.63) k = k0γAγBγ ‡
относительно значения в идеальной среде, k 0 ,
(9.64) logk = logk0 + logγA + logγB− logγ ‡
Введение коэффициентов активности из ур. (9.62) получаем
(9.65) logk = logk0 − A [ZA2 + ZB2− (ZA + ZB) 2] I
, что может быть записано как
(9.66) logk = logk0 + 2AZAZBI
. значение A для водных растворов при 25 ° C, это становится
(9.67) logkk0≈1.02ZAZBI (moldm – 3) 1/2
На рисунке 9.13 показано подтверждение этих предсказаний эффектов ионной силы в растворе для следующей группы реакций между ионами [15,16]:
Рисунок 9.13. Влияние ионной силы на кинетику ионных реакций в водных растворах. Реакции (9.XIV) — (9.XXI) приведены в тексте. Наклоны равны 1,02 Z A Z B .
(9. XIV) Co (Nh4) 5Br2 ++ Hg2 + →
XIV) Co (Nh4) 5Br2 ++ Hg2 + →
(9.XV) S2O82− + I− →
(9.XVI) CO (OC2H5) N: NO2− + OH− →
(9.XVII) [Cr (мочевина) 6] 3 ++ h3O →
(9.XVIII) Ch4COOC2H5 + OH− →
(9. XIX) H ++ Br– + h3O2 →
(9.XX) Co (Nh4) 5Br2 ++ OH− →
(9.XXI) Fe2 ++ Co (C2O4) 3− →
Увеличение I увеличивает константу скорости реакций между ионами одного заряда и уменьшает ее, когда ионы заряжены противоположно. Этот кинетический эффект добавления соли к растворам, когда соль не участвует в реакции, был подробно изучен Бренстедом [17] и Бьеррумом [18], и выражение, которое оно представляет, известно как Бренстеда. –Уравнение Бьеррама .
Для реакций, в которых одна из разновидностей является нейтральной, ионная сила не должна иметь никакого эффекта. На практике часто наблюдаются небольшие эффекты изменения ионной силы, когда реакции катализируются кислотами или основаниями. Они известны как вторичные солевые эффекты и обусловлены влиянием ионной силы на кислотно-щелочное равновесие.
Химический, молярный и массовый процент
Растворы представляют собой однородные (равномерно распределенные) смеси двух или более химических веществ. Растворы могут существовать в виде твердых тел, жидкостей или газов.
Все растворы содержат растворитель и одно или несколько растворенных веществ. Растворитель, часто вода, является наиболее распространенным химическим веществом. Растворенное вещество — это менее распространенные химические вещества.
Создание решений
Как растворять твердые частицы и уменьшать масштабы экспериментов
Для экспериментов вам часто потребуется растворять растворенные вещества в твердой форме, чтобы получить растворы определенной силы (сила измеряется по диссоциации ионов). Запланируйте один час на каждые 2-4 раствора, которые вам нужно приготовить.Вам потребуются весы для взвешивания растворенного вещества и градуированный цилиндр для измерения растворителя (если это вода).
Во-первых, определите концентрацию (массовый процент или молярность, см. Ниже) и количество (миллилитры) раствора, которое вам нужно в лабораторной процедуре. Во-вторых, рассчитайте необходимое количество растворенного вещества в граммах, используя одну из формул, приведенных ниже. Затем взвесьте растворенное вещество и добавьте его в стакан для смешивания. Наконец, измерьте необходимый объем воды в миллилитрах с помощью градуированного цилиндра и добавьте его в стакан.Размешайте раствор, пока все химическое вещество не растворится.
Ниже) и количество (миллилитры) раствора, которое вам нужно в лабораторной процедуре. Во-вторых, рассчитайте необходимое количество растворенного вещества в граммах, используя одну из формул, приведенных ниже. Затем взвесьте растворенное вещество и добавьте его в стакан для смешивания. Наконец, измерьте необходимый объем воды в миллилитрах с помощью градуированного цилиндра и добавьте его в стакан.Размешайте раствор, пока все химическое вещество не растворится.
Разбейте твердые куски химического вещества ступкой и пестиком или осторожно раздавив молотком в полиэтиленовом пакете. Химические вещества растворяются быстрее при осторожном нагревании раствора и перемешивании.
Вы можете рассмотреть возможность уменьшения масштаба, когда эксперименты требуют большого количества химикатов. Уменьшение масштаба снижает риски безопасности, химические затраты и удаление отходов.
Большинство экспериментов можно уменьшить, разделив растворенное вещество и растворитель на коэффициент по вашему выбору.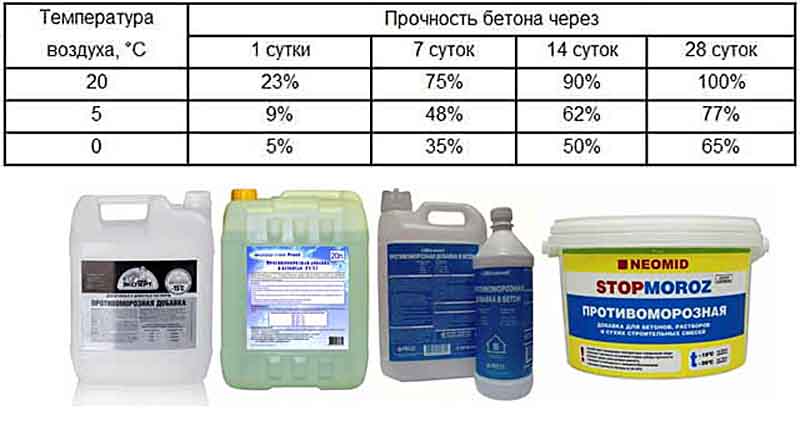 Например, эксперимент, требующий 50 г растворителя и 250 мл воды, можно уменьшить в 10 раз, чтобы использовать только 5 г растворителя и 25 мл воды. Вы можете упростить масштабирование, используя мензурки, пробирки и другое измерительное оборудование меньшего размера.
Например, эксперимент, требующий 50 г растворителя и 250 мл воды, можно уменьшить в 10 раз, чтобы использовать только 5 г растворителя и 25 мл воды. Вы можете упростить масштабирование, используя мензурки, пробирки и другое измерительное оборудование меньшего размера.
При приготовлении химических растворов всегда используйте соответствующее защитное оборудование.
Как приготовить молярные растворы
Молярные (М) растворы основаны на количестве молей химического вещества в одном литре раствора.Моль состоит из 6,02 × 10 23 молекул или атомов. Молекулярный вес (MW) — это вес одного моля химического вещества. Определите молекулярную массу с помощью таблицы Менделеева, добавив атомную массу каждого атома в химическую формулу.
Пример: для молекулярной массы CaCl 2 добавьте атомную массу Ca (40,01) к атомной массе двух Cl (2 x 35,45), чтобы получить 110,91 г / моль. Следовательно, 1М раствор CaCl 2 состоит из 110,91 г CaCl 2 , растворенных в воде, достаточной для приготовления одного литра раствора.
Как только молекулярная масса растворенного вещества известна, масса химического вещества, которое должно раствориться в растворе для молярного раствора менее 1M, рассчитывается по формуле:
- граммов химического вещества = (молярность раствора в моль / литр) x (молекулярная масса химического вещества в г / моль) x (мл раствора) ÷ 1000 мл / литр
Например, чтобы приготовить 100 мл 0,1 М раствора CaCl 2 , используйте предыдущую формулу, чтобы узнать, сколько CaCl 2 вам нужно:
- грамм CaCl 2 = (0.1) x (110,91) x (100) ÷ (1000) = 1,11 г
Теперь вы можете приготовить свой раствор: растворите 1,11 г CaCl 2 в воде, достаточной для получения 100 мл раствора. Необходимое количество воды будет чуть меньше 100 мл.
Для приготовления молярных растворов используются весы и мерная колба. Процедура приготовления молярного раствора с помощью мерной колбы на 100 мл следующая:
- Рассчитайте вес растворенного вещества, необходимый для приготовления 100 мл раствора, используя приведенную выше формулу.

- Взвесьте необходимое количество растворенного вещества на весах.
- Перенесите растворенное вещество в чистую сухую мерную колбу на 100 мл.
- Медленно добавьте дистиллированную воду в мерную колбу. При этом промойте все растворенное вещество на дне колбы. Продолжайте добавлять воду, пока не дойдете до отметки 100 мл на горлышке колбы.
- Поместите пробку в колбу и осторожно покрутите колбу, пока все растворенное вещество не растворится.
Если у вас нет мерной колбы, вы можете использовать мерный цилиндр на 100 мл.Просто добавьте растворенное вещество в мерный цилиндр, а затем добавьте дистиллированную воду, пока не достигнете отметки 100 мл на боковой стороне цилиндра.
Как приготовить растворы в процентах по массе
В растворах массовых процентов вес растворенного вещества делится на вес раствора (растворенное вещество + вода) и умножается на 100. Поскольку плотность воды составляет 1 г / мл, формула для расчета количества растворенного вещества, которое должно быть смешанным для получения массового процента раствора:
- граммов растворенного вещества = (вес.
 % Раствора) x (мл воды) ÷ (100 — вес.% Раствора)
% Раствора) x (мл воды) ÷ (100 — вес.% Раствора)
В качестве примера, чтобы приготовить 100 мл 10% раствора NaCl (поваренной соли), используйте предыдущую формулу, чтобы узнать, сколько NaCl вам нужно:
- граммов NaCl = (10) x (100) ÷ (100-10) = 11.1 г
Теперь вы можете приготовить свой раствор: растворите 11,1 г NaCl в 100 мл воды.
Создайте собственное решение для этих проектов:
Frozen Bubbles
Радужная реакция
Биологический тест на токсичность
Гальваника: ключ с медным покрытием
раствор | Определение и примеры
раствор , в химии, гомогенная смесь двух или более веществ в относительных количествах, которые можно непрерывно изменять до так называемого предела растворимости.Термин «раствор» обычно применяется к жидкому состоянию вещества, но возможны и растворы газов и твердых тел. Например, воздух — это раствор, состоящий в основном из кислорода и азота с небольшими количествами нескольких других газов, а латунь — это раствор, состоящий из меди и цинка.
Ниже приводится краткое описание решений. Для полной обработки см. жидкость: Растворы и растворимости.
Подробнее по этой теме
жидкость: Растворы и растворимость
Способность жидкостей растворять твердые тела, другие жидкости или газы давно признана одним из фундаментальных явлений природы…
Жизненные процессы во многом зависят от решений. Кислород из легких переходит в раствор в плазме крови, химически соединяется с гемоглобином в красных кровяных тельцах и попадает в ткани организма. Продукты пищеварения также разносятся в растворе к различным частям тела. Способность жидкостей растворять другие жидкости или твердые вещества имеет множество практических применений. Химики используют разницу в растворимости для разделения и очистки материалов, а также для проведения химического анализа.Большинство химических реакций происходит в растворе и зависит от растворимости реагентов. Материалы для химического производственного оборудования выбираются таким образом, чтобы противостоять действию растворителей, которые их содержимое.
Материалы для химического производственного оборудования выбираются таким образом, чтобы противостоять действию растворителей, которые их содержимое.
Жидкость в растворе обычно называется растворителем, а добавляемое вещество называется растворенным веществом. Если оба компонента являются жидкостями, различие теряет значение; тот, который присутствует в меньшей концентрации, вероятно, будет называться растворенным веществом. Концентрация любого компонента в растворе может быть выражена в единицах веса или объема или в молях.Они могут быть смешаны, например, молей на литр и молей на килограмм.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас Кристаллы некоторых солей содержат решетки ионов, то есть атомы или группы атомов с чередующимися положительными и отрицательными зарядами. Когда такой кристалл должен быть растворен, притяжение противоположно заряженных ионов, которые в значительной степени ответственны за сцепление в кристалле, должно преодолеваться электрическими зарядами в растворителе. Они могут быть обеспечены ионами конденсированной соли или электрическими диполями в молекулах растворителя.Такие растворители включают воду, метиловый спирт, жидкий аммиак и фтороводород. Ионы растворенного вещества, окруженные диполярными молекулами растворителя, отделяются друг от друга и могут свободно перемещаться к заряженным электродам. Такой раствор может проводить электричество, а растворенное вещество называется электролитом.
Они могут быть обеспечены ионами конденсированной соли или электрическими диполями в молекулах растворителя.Такие растворители включают воду, метиловый спирт, жидкий аммиак и фтороводород. Ионы растворенного вещества, окруженные диполярными молекулами растворителя, отделяются друг от друга и могут свободно перемещаться к заряженным электродам. Такой раствор может проводить электричество, а растворенное вещество называется электролитом.
Потенциальная энергия притяжения между простыми неполярными молекулами (неэлектролитами) имеет очень малый диапазон; оно уменьшается примерно как седьмая степень расстояния между ними.Для электролитов энергия притяжения и отталкивания заряженных ионов падает только как первая степень расстояния. Соответственно, их растворы имеют свойства, сильно отличающиеся от свойств неэлектролитов.
Обычно предполагается, что все газы полностью смешиваются (взаимно растворимы во всех пропорциях), но это верно только при нормальном давлении. При высоких давлениях пары химически разнородных газов вполне могут проявлять лишь ограниченную смешиваемость. Многие разные металлы смешиваются в жидком состоянии, иногда образуя узнаваемые соединения.{-} (aq) \]
Многие разные металлы смешиваются в жидком состоянии, иногда образуя узнаваемые соединения.{-} (aq) \]
Это обратимая реакция. Небольшая часть молекул воды распадается с образованием ионов водорода и гидроксид-ионов. Некоторые из этих ионов водорода и гидроксида затем снова взаимодействуют вместе с образованием молекул воды.
Это называется равновесием и присутствует в воде и всех водных растворах.
В воде и нейтральных растворах концентрация ионов водорода равна концентрации гидроксид-ионов.
Все кислые растворы содержат больше ионов водорода, чем гидроксид-ионов.
Все щелочные растворы содержат больше гидроксид-ионов, чем ионов водорода.
Разбавление кислот и оснований
26wdgog3xui.0.0.0.1:0.1.0.$0.$2.$1″> Добавление воды к кислоте или основанию изменит ее pH. Вода в основном состоит из молекул воды, поэтому добавление воды к кислоте или основанию снижает концентрацию ионов в растворе.Когда кислый раствор разбавляется водой, концентрация ионов H + уменьшается, а pH раствора увеличивается до 7.
Чтобы изменить pH на 1, требуется десятикратное разбавление (например, добавление 9 см 3 воды на 1 см 3 кислоты).Кислота становится менее кислой.
Аналогично, когда щелочь разбавляется водой, концентрация ионов OH — уменьшается. Это приводит к падению pH щелочи до 7, делая раствор менее щелочным при добавлении большего количества воды.
Это приводит к падению pH щелочи до 7, делая раствор менее щелочным при добавлении большего количества воды.
pKa и равновесие диссоциации: SHIMADZU (Shimadzu Corporation)
1. pH
Когда соляная кислота или другая кислота добавляется в воду, уровень pH снижается. Кислотность раствора определяется концентрацией протонов (иона водорода) ([H + ]), где pH обеспечивает простой показатель для выражения уровня [H + ].pH указывается в терминах следующего выражения, где чем меньше число, тем выше кислотность (более высокая концентрация протонов).
Одним из важных моментов, касающихся pH, является то, что изменение значения pH только на 1 эквивалентно 10-кратному изменению концентрации протонов.
Примечание. Следует использовать уровень активности, а не концентрацию, но вместо активности использовалась концентрация, потому что концентрация часто соответствует уровню активности в аналитических концентрациях, и это проще (то же самое применяется ниже).
2. pKa и равновесие диссоциации
Кислоты включают сильные кислоты, которые полностью диссоциируют в воде, и слабые кислоты, которые диссоциируют лишь частично. Когда кислота диссоциирует, она высвобождает протон, чтобы сделать раствор кислым, но слабые кислоты имеют как диссоциированное состояние (A — ), так и недиссоциированное состояние (AH), которые сосуществуют в соответствии со следующим уравнением равновесия диссоциации.
Отношение концентраций обеих сторон является постоянным при фиксированных аналитических условиях и называется константой диссоциации кислоты (Ka).Ka определяется следующим уравнением.
В квадратных скобках указаны концентрации соответствующих компонентов. Основываясь на этом уравнении, Ka выражает, насколько легко кислота высвобождает протон (другими словами, ее силу как кислоты). Кроме того, уравнение показывает, как состояние диссоциации слабых кислот изменяется в зависимости от уровня [H + ] в растворе.
Карбоновые кислоты (содержащие -COOH), такие как уксусная и молочная кислоты, обычно имеют константу Ka примерно от 10 -3 до 10 -6 .Следовательно, выражение кислотности только с помощью константы Ka может быть неудобным и не очень интуитивно понятным.
Следовательно, pKa был введен как индекс для выражения кислотности слабых кислот, где pKa определяется следующим образом.
Например, константа Ka для уксусной кислоты (CH 3 COOH) составляет 0,0000158 (= 10 -4,8 ), но константа pKa равна 4,8, что является более простым выражением. Кроме того, чем меньше значение pKa, тем сильнее кислота. Например, значение pKa молочной кислоты составляет около 3.8, это означает, что молочная кислота является более сильной кислотой, чем уксусная кислота.
3. pKa и буферная емкость
Еще одним важным моментом является взаимосвязь между pH и pKa кислоты. Эта связь описывается следующим уравнением.
Это уравнение можно переформулировать следующим образом.
Это показывает, как pKa и pH равны, когда диссоциировала ровно половина кислоты ([A — ] / [AH] = 1). Если pH изменяется на 1 около значения pKa, статус диссоциации кислоты изменяется на чрезвычайно большую величину.
Рис. Взаимосвязь между pH раствора и состоянием диссоциации уксусной кислоты
В случае уксусной кислоты, например, если pH раствора изменяется около 4,8, это вызывает большое изменение в присутствии уксусной кислоты. При pH 3,8 более 90% существуют в виде молекул уксусной кислоты (CH 3 COOH), но при pH 5,8 более 90% существуют в виде ионов ацетата (CH 3 COO — ).
И наоборот, чтобы изменить уровень pH, близкий к значению pKa кислоты, необходимо значительно изменить статус диссоциации кислоты, что требует использования чрезвычайно большого количества кислоты или основания.Способность вещества поддерживать pH таких растворов называется его буферной емкостью, где чем ближе pKa и pH, тем выше буферная емкость.



 Сколько миллилитров 1,10 M H 2 SO 4 следует разбавить водой, чтобы приготовить 0,500 л 0,025 M H 2 SO 4 ?
Сколько миллилитров 1,10 M H 2 SO 4 следует разбавить водой, чтобы приготовить 0,500 л 0,025 M H 2 SO 4 ?

 % Раствора) x (мл воды) ÷ (100 — вес.% Раствора)
% Раствора) x (мл воды) ÷ (100 — вес.% Раствора)